При взаимодействии гранул меди с разбавленным раствором серной кислоты, содержащий также сульфат меди, в присутствии воздуха, кислород воздуха растворяется в кислоте, диффундирует к поверхности меди и окисляет ее до закиси меди:
Закись меди растворяется в серной кислоте:
Образующийся сульфат закиси меди легко окисляется в сульфат окиси меди:
Общая скорость процесса лимитируется наиболее медленной его стадией — окислением меди до закиси. Это объясняется малой растворимостью кислорода и медленной его диффузией к поверхности гранул меди. Процесс значительно ускоряется, когда в растворе уже присутствует медный купорос. В результате деполяризации
Cu + Cu 2+ = 2Cu 2+
CuSO4 восстанавливается медью до Cu2SO4, а затем Cu2SO4 вновь окисляется растворенным кислородом до CuSO4. Таким образом, медный купорос играет роль переносчика кислорода.
В присутствии металлической меди в растворе медного купороса может находиться лишь ничтожное количество одновалентной меди. Константа равновесия реакции Cu 2+ + Cu -2Cu + при 25° К = [Cu + ] 2 : [Cu 2+ ] = 0,62·10 -6 . В растворе, содержащим 50 г/л H2SO4 и 32 г/л Cu в виде CuSO4, имеется только ? 0,022 г/л одновалентной меди, т.е. меньше 0,1 % от общего ее количества.
Повышение температуры, как и в других случаях, ускоряет химические реакции, но вызывает уменьшение растворимости кислорода, что замедляет окисление. Поэтому в натравочной башне поддерживают температуру не выше 80 -85°. При этом при окислении меди используется приблизительно ј кислорода, поступающего в башню с воздухом, расход которого составляет 1000 нм 3 на 1т медного купороса.
Растворимость кислорода уменьшается с ростом концентрации CuSO4 в растворе. Поэтому при увеличении концентрации CuSO4 скорость растворения меди сначала увеличивается за счет каталитического действия CuSO4, а затем уменьшается вследствие недостатка кислорода. Максимум скорости растворения наблюдается при концентрации 120 г/л CuSO4 (для раствора содержащего
110 г/л H2SO4). Но даже при содержании в растворе 300 г/л CuSO4 скорость растворения меди в 1,6 раза больше, чем в отсутствие медного купороса. С увеличением концентрации серной кислоты растворимость кислорода в ней уменьшается, но усиливаются ее окислительные свойства. Поэтому повышение кислотности раствора вызывает не очень большое уменьшение скорости растворения меди — всего на 10% при повышении концентрации H2SO4 с 2,5 до 20%. Растворение меди значительно ускоряется в присутствии в растворе ионов железа вследствие деполяризации
4Fe 2+ + O2 +4H + = 4Fe 3+ + 2H2O
2Cu + 4Fe 3+ = 2Cu 2+ + 4Fe 2+
Ионы Fe 2+ вновь окисляются до Fe 3+ и служат, таким образом, катализатором процесса. Доля растворяющейся меди под действием ионов Fe 3+ в растворе, содержащем
110 г/л H2SO4, 60 г/л CuSO4 и 20 — 22 г/л FeSO4, составляет около 60% от всего количества меди, перешедшей в раствор.
Ионы железа попадают в циркулирующий при растворении меди раствор с серной кислотой и вследствие растворения оставшихся в меди примесей. Содержание сульфатов железа в растворе непрерывно возрастает и достигает иногда 70 г/л и более. Вследствие этого при кристаллизации медного купороса выделяется также и сульфат железа. Поэтому когда концентрация железа в растворе становится столь большой, что создается опасность получения нестандартного по содержанию железа медного купороса, раствор полностью выводят из обращения.
Существенным является обеспечение равномерного орошения (смачивания) гранул меди раствором. В местах, плохо орошаемых кислотой, образовавшаяся окисная пленка растворяется не полностью, появляется основной сульфат меди CuSO4·2Cu(OH)2, который вследствие малой своей растворимости кристаллизуется из раствора и цементирует при этом гранулы и шлам.
- Кристаллизация медного купороса
- Содержание
- Нахождение в природе [ править | править код ]
- Получение [ править | править код ]
- В промышленности [ править | править код ]
- В лабораторных условиях [ править | править код ]
- Очистка [ править | править код ]
- Глубокая очистка [ править | править код ]
- Физические свойства [ править | править код ]
- Строение кристаллогидрата [ править | править код ]
- Термическое воздействие [ править | править код ]
- Растворимость [ править | править код ]
- Химические свойства [ править | править код ]
- Электролитическая диссоциация [ править | править код ]
- Реакция замещения [ править | править код ]
- Реакция с растворимыми основаниями (щелочами) [ править | править код ]
- Сокращённое ионное уравнение (Правило Бертолле) [ править | править код ]
- Реакция обмена с другими солями [ править | править код ]
- Прочее [ править | править код ]
- Производство и применение [ править | править код ]
- Токсикология [ править | править код ]
Кристаллизация медного купороса
Медный купорос хорошо растворим в воде:
Таблица 3. Растворимость медного купороса в воде
| Сульфат меди | |
|---|---|
 |
|
 |
|
| Общие | |
| Систематическое наименование |
сульфат меди(II) |
| Традиционные названия | пентагидрат: медный купорос |
| Хим. формула | Cu S O 4 |
| Физические свойства | |
| Состояние | кристаллическое |
| Молярная масса | 159,609 (сульфат) 249.685 (пентагидрат) г/моль |
| Плотность | 3,64 г/см³ |
| Твёрдость | 2,5 [1] |
| Термические свойства | |
| Т. разл. | выше 650 °C |
| Химические свойства | |
| pKa | 5⋅10 −3 |
| Структура | |
| Координационная геометрия | Октаэдрическая |
| Кристаллическая структура | безв. — ромбическая пентагидрат — триклинная пинакоидальная тригидрат — моноклинная |
| Классификация | |
| Рег. номер CAS | 7758-98-7 |
| PubChem | 24462 |
| Рег. номер EINECS | 231-847-6 |
| SMILES | |
| Кодекс Алиментариус | E519 |
| RTECS | GL8800000 |
| ChEBI | 23414 |
| ChemSpider | 22870 |
| Безопасность | |
| ПДК | в воздухе: мр 0,009, сс 0,004; в воде: 0,001 |
| ЛД50 |
крысы, орально [2] : 612,9 мг/кг мыши, орально: 87 мг/кг |
| Токсичность | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Сульфа́т ме́ди(II) (медь серноки́слая, ме́дный купоро́с) — неорганическое соединение, медная соль серной кислоты с формулой Cu S O 4. Нелетучее вещество, не имеет запаха. В безводном виде — белый порошок, очень гигроскопичное. В виде кристаллогидратов — прозрачные негигроскопичные кристаллы различных оттенков синего с горьковато-металлическим вяжущим вкусом, на воздухе постепенно выветриваются (теряют кристаллизационную воду).
Сульфат меди(II) хорошо растворим в воде. Из водных растворов кристаллизуется голубой пентагидрат CuSO4·5H2O — медный купоро́с. Токсичность медного купороса для теплокровных животных относительно невысока, в то же время, он высокотоксичен для рыб.
Обладает дезинфицирующими, антисептическими, вяжущими свойствами. Применяется в медицине, в растениеводстве как антисептик, фунгицид или медно-серное удобрение.
Реакция гидратации безводного сульфата меди(II) экзотермическая и проходит со значительным выделением тепла.
Содержание
Нахождение в природе [ править | править код ]
Получение [ править | править код ]
В промышленности [ править | править код ]
В промышленности загрязнённый сульфат меди(II) получают растворением меди и медных отходов в разбавленной серной кислоте H2SO4 при продувании воздуха:
2 C u + O 2 + 2 H 2 S O 4 → 2 C u S O 4 + 2 H 2 O , <displaystyle <mathsf <2Cu+O_<2>+2H_<2>SO_<4>
ightarrow 2CuSO_<4>+2H_<2>O>>,>
C u O + H 2 S O 4 → C u S O 4 + H 2 O , <displaystyle <mathsf <2>SO_<4>
ightarrow CuSO_<4>+H_<2>O>>,>
сульфатизирующим обжигом сульфидов меди и как побочный продукт электролитического рафинирования меди.
В лабораторных условиях [ править | править код ]
В лаборатории CuSO4 можно получить действием концентрированной серной кислоты на медь при нагревании:
C u + 2 H 2 S O 4 → C u S O 4 + S O 2 ↑ + 2 H 2 O , <displaystyle <mathsf <2>SO_<4>
ightarrow CuSO_<4>+SO_<2>uparrow +2H_<2>O>>,>
температура не должна превышать 60 °С, при большей температуре в значительных количествах образуется побочный продукт — сульфид меди(I):
5 C u + 4 H 2 S O 4 → 3 C u S O 4 + C u 2 S ↓ + 4 H 2 O . <displaystyle <mathsf <5Cu+4H_<2>SO_<4>
ightarrow 3CuSO_<4>+Cu_<2>Sdownarrow +4H_<2>O>>.>
Также в лабораторных условиях сульфат меди (II) может быть получен реакцией нейтрализации гидроксида меди(II) серной кислотой, для получения сульфата меди высокой чистоты используют соответственно чистые реактивы:
C u ( O H ) 2 + H 2 S O 4 → C u S O 4 + 2 H 2 O . <displaystyle <mathsf <2>+H_<2>SO_<4>
ightarrow CuSO_<4>+2H_<2>O>>.>
Чистый сульфат меди может быть получен следующим образом. В фарфоровую чашку наливают 120 мл дистиллированной воды, прибавляют 46 мл химически чистой серной кислоты плотностью 1,8 г/см 3 и помещают в смесь 40 г чистой меди (например, электролитической). Затем нагревают до 70—80 °С и при этой температуре в течение часа постепенно, порциями по 1 мл, прибавляют 11 мл конц. азотной кислоты. Если медь покроется кристаллами, прибавить 10—20 мл воды. Когда реакция закончится (прекратится выделение пузырьков газа), остатки меди вынимают, а раствор упаривают до появления на поверхности плёнки кристаллов и дают остыть. Выпавшие кристаллы следует 2—3 перекристаллизовать из дистиллированной воды и высушить [4] .
Очистка [ править | править код ]
Очистить загрязнённый или технический сульфат меди можно перекристаллизацией — вещество растворяется в кипящей дистиллированной воде до насыщения раствора, после чего охлаждается до приблизительно +5 °С. Полученный осадок кристаллов отфильтровывается. Однако даже многократная перекристаллизация не позволяет избавиться от примеси соединений железа, которые являются наиболее распространённой примесью в сульфате меди.
Для полной очистки медный купорос кипятят с диоксидом свинца PbO2 или пероксидом бария BaO2, пока отфильтрованная проба раствора не покажет отсутствия железа. Затем раствор фильтруют и упаривают до появления на поверхности плёнки кристаллов, после чего охлаждают для кристаллизации [4] .
По Н. Шоорлю очистить сульфат меди можно так: к горячему раствору CuSO4 прибавить небольшие количества пероксида водорода H2O2 и гидроксида натрия NaOH, прокипятить и отфильтровать осадок. Выпавшие из фильтрата кристаллы дважды подвергаются перекристаллизации. Полученное вещество имеет чистоту не ниже квалификации «ХЧ» [4] .
Глубокая очистка [ править | править код ]
Существует более сложный способ очистки, позволяющий получить сульфат меди особой чистоты, с содержанием примесей около 2·10 -4 %.
Для этого готовится водный, насыщенный при 20°С раствор сульфата меди (вода используются только бидистиллированная). В него добавляют перекись водорода в количестве 2-3 мл 30 % раствора на 1 литр, перемешивают, вносят свежеосаждённый основной карбонат меди в количестве 3-5 грамм, нагревают и кипятят 10 минут для разложения H2O2.
Затем раствор охлаждают до 30—35 °С, фильтруют и приливают 15 мл 3%-ного раствора диэтилдитиокарбамата натрия и выдерживают в мешалке три-четыре часа не понижая температуры. Далее раствор быстро процеживают от крупных хлопьев комплексов и вносят активированный уголь БАУ-А на полчаса при перемешивании. Затем раствор следует отфильтровать вакуумным методом.
Дальше в раствор CuSO4 приливают на 1 л около 200 мл насыщенного раствора NaCl квалификации «Ч» и вносят чистый алюминий в проволоке или обрезках до полного прохождения реакции, выделения меди и просветления раствора (при этом выделяется водород). Выделенную медь отделяют от алюминия взбалтыванием, осадок промывают декантацией сперва водой затем заливают горячим 5—10 % раствором соляной кислоты ХЧ при взбалтывании в течение часа и постоянным подогревом до 70—80 °С, затем промывают водой и заливают 10—15%-ной серной кислотой (ОСЧ 20-4) на час с подогревом при том же интервале температур. От степени и тщательности промывания кислотами, а также квалификации применяемых далее реактивов зависит чистота дальнейших продуктов.
После промывки кислотами медь снова моют водой и растворяют в 15—20%-ной серной кислоте (ОСЧ 20-4) без её большого избытка с добавлением перекиси водорода (ОСЧ 15-3). После прохождения реакции полученный кислый раствор сульфата меди кипятят для разложения избытка перекиси и нейтрализуют до полного растворения вначале выпавшего осадка перегнанным 25%-ным раствором аммиака (ОСЧ 25-5) или приливают раствор карбоната аммония, очищенного комплексно-адсорбционным методом до особо чистого.
После выстаивания в течение суток раствор медленно фильтруют. В фильтрат добавляют серную кислоту (ОСЧ) до полного выпадения голубовато-зелёного осадка и выдерживают до укрупнения и перехода в зелёный основной сульфат меди. Зелёный осадок выстаивают до компактности и тщательно промывают водой до полного удаления растворимых примесей. Затем осадок растворяют в серной кислоте, фильтруют, устанавливают рН=2,5—3,0 и перекристаллизовывают два раза при быстром охлаждении, причем при охлаждении раствор каждый раз перемешивают для получения более мелких кристаллов сульфата меди. Выпавшие кристаллы переносят на воронку Бюхнера и удаляют остатки маточного раствора с помощью водоструйного насоса. Третья кристаллизация проводится без подкисления раствора с получением чуть более крупных и оформленных кристаллов [5] .
Физические свойства [ править | править код ]
Пентагидрат сульфата меди(II) (медный купорос) — синие прозрачные кристаллы триклинной сингонии. Плотность 2,284 г/см 3 . При температуре 110 °С отщепляется 4 молекулы воды, при 150 °С происходит полное обезвоживание [6] .
Строение кристаллогидрата [ править | править код ]
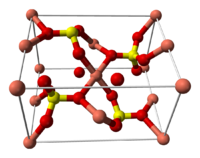
Структура медного купороса приведена на рисунке. Как видно, вокруг иона меди координированы два аниона SO4 2− по осям и четыре молекулы воды (в плоскости), а пятая молекула воды играет роль мостиков, которые при помощи водородных связей объединяют молекулы воды из плоскости и сульфатную группу.
Термическое воздействие [ править | править код ]
При нагревании пентагидрат последовательно отщепляет две молекулы воды, переходя в тригидрат CuSO4·3H2O (этот процесс, выветривание, медленно идёт и при более низких температурах [в том числе при 20—25 °С]), затем в моногидрат (при 110 °С) CuSO4·H2O, и выше 258 °C образуется безводная соль.
Выше 650 °C становится интенсивным пиролиз безводного сульфата по реакции:
2 C u S O 4 → o t 2 C u O + 2 S O 2 + O 2 <displaystyle <mathsf <2CuSO_<4><xrightarrow[<>]<^
Растворимость [ править | править код ]
Растворимость сульфата меди(II) по мере роста температуры проходит через плоский максимум, в течение которого растворимость соли почти не меняется (в интервале 80—200 °C). (см. рис.)
Как и все соли, образованные ионами слабого основания и сильной кислоты, сульфат меди(II) гидролизуется, (степень гидролиза в 0,01 М растворе при 15 °C составляет 0,05 %) и даёт кислую среду (pH указанного раствора 4,2). Константа диссоциации составляет 5⋅10 −3 .
Химические свойства [ править | править код ]
Электролитическая диссоциация [ править | править код ]
CuSO4 — хорошо растворимая в воде соль и сильный электролит, в растворах сульфат меди(II) так же, как и все растворимые соли, диссоциирует в одну стадию:
C u S O 4 → C u 2 + + S O 4 2 − . <displaystyle <mathsf <4>
ightarrow Cu^<2+>+SO_<4>^<2->>>.>
Реакция замещения [ править | править код ]
Реакция замещения возможна в водных растворах сульфата меди с использованием металлов активнее чем медь, стоящих левее меди в электрохимическом ряду напряжения металлов:
C u S O 4 + Z n → C u ↓ + Z n S O 4 . <displaystyle <mathsf <4>+Zn
ightarrow Cudownarrow +ZnSO_<4>>>.>
Реакция с растворимыми основаниями (щелочами) [ править | править код ]
Сульфат меди(II) реагирует с щелочами с образованием осадка гидроксида меди(II) голубого цвета [7] :
C u S O 4 + 2 K O H → C u ( O H ) 2 ↓ + K 2 S O 4 <displaystyle <mathsf <4>+2KOH
ightarrow Cu(OH)_<2>downarrow +K_<2>SO_<4>>>> 
ightarrow Cu(OH)_<2>downarrow +Li_<2>SO_<4>>>> 
ightarrow Cu(OH)_<2>downarrow +Na_<2>SO_<4>>>>
Сокращённое ионное уравнение (Правило Бертолле) [ править | править код ]
Реакция обмена с другими солями [ править | править код ]
Сульфат меди вступает также в обменные реакции по ионам Cu 2+ и SO4 2-
C u S O 4 + B a C l 2 → C u C l 2 + B a S O 4 ↓ <displaystyle <mathsf <4>+BaCl_<2>
ightarrow CuCl_<2>+BaSO_<4>downarrow >>> 
ightarrow CuSdownarrow +K_<2>SO_<4>>>>
Прочее [ править | править код ]
С сульфатами щелочных металлов и аммония образует комплексные соли, например, Na2[Cu(SO4)2]·6H2O.
Ион Cu 2+ окрашивает пламя в зелёный цвет.
Производство и применение [ править | править код ]
Сульфат меди(II) — один из важнейших солей меди. Часто служит исходным сырьём для получения других соединений меди.
Безводный сульфат меди — хороший влагопоглотитель и может быть использован для абсолютирования этанола, осушения газов (в том числе воздуха) и как индикатор влажности.
Лёгкость выращивания кристаллов пентагидрата сульфата меди и их резкое различие с безводной формой используются в школьном образовании.
В строительстве водный раствор сульфата меди применяется для нейтрализации последствий протечек, ликвидации пятен ржавчины, а также для удаления выделений солей («высолов») с кирпичных, бетонных и оштукатуренных поверхностей, а также как антисептическое и фунгицидное средство для предотвращения гниения древесины.
В сельском хозяйстве медный купорос применяется как антисептик, фунгицид и медно-серное удобрение. Для обеззараживания ран деревьев используется 1%-ный раствор (100 г на 10 л), который втирается в предварительно зачищенные повреждённые участки. Против фитофтороза томатов и картофеля производятся опрыскивания посадок 0,2 % раствором (20 г на 10 л) при первых признаках заболевания, а также для профилактики при угрозе возникновения болезни (например, в сырую влажную погоду). Раствором сульфата меди поливается почва для обеззараживания и восполнения недостатка серы и меди (5 г на 10 л). Однако чаще медный купорос применяется в составе бордо́ской жидкости — основного сульфата меди CuSO4·3Cu(OH)2 против грибковых заболеваний и виноградной филлоксеры. Для этих целей сульфат меди(II) имеется в розничной торговле.
Для борьбы с цветением воды в водохранилищах также используется химическая обработка медным купоросом [8] .
Также он применяется для изготовления минеральных красок, в медицине, как один из компонентов электролитических ванн для меднения и т. п. и в составе прядильных растворов в производстве ацетатного волокна.
В пищевой промышленности зарегистрирован в качестве пищевой добавки E519. Используется как фиксатор окраски и консервант.
В быту применяют для выведения пятен ржавчины на потолке после затоплений.
В пунктах скупки лома цветных металлов раствор медного купороса применяется для выявления цинка, марганца и магния в алюминиевых сплавах и нержавейке. При выявлении этих металлов появляются красные пятна.
Токсикология [ править | править код ]
Сульфат меди(II) является соединением с умеренной токсичностью и относится к классу опасности 4 (малоопасное вещество). Смертельная доза медного купороса составляет от 45 до 125 граммов для взрослого человека перорально (при проглатывании), в зависимости от массы, состояния здоровья, иммунитета к избытку меди и от других факторов. Признаки отравления становится заметным при разовом потреблении более 0,5 г соединения внутрь (т. н. токсическая доза). LD50 для крыс 612,9 мг/кг [2] . Картина отравления при вдыхании аэрозолей более сложна.
Попадание на кожу сухого вещества безопасно, но его необходимо смыть. Аналогично при попадании растворов и увлажнённого твердого вещества. При попадании в глаза необходимо обильно промыть их проточной водой (слабой струёй). При попадании в желудочно-кишечный тракт твердого вещества или концентрированных растворов необходимо промыть желудок пострадавшего 0,1 % раствором марганцовки, дать выпить пострадавшему солевое слабительное — сульфат магния 1—2 ложки, вызвать рвоту, дать мочегонное. Кроме того, попадание в рот и желудок безводного вещества может вызвать термические ожоги.
Слабые растворы сульфата меди при приёме внутрь действуют как сильное рвотное средство и иногда применяются для провоцирования рвоты.
При работе с порошками и пылью сульфата меди(II), следует соблюдать осторожность и не допускать их пыления, необходимо использовать маску или респиратор, а после работы вымыть лицо. Острая токсическая доза при вдыхании аэрозоля — 11 мг/кг [9] . При попадании сульфата меди через дыхательные пути в виде аэрозоля нужно вывести пострадавшего на свежий воздух, прополоскать рот водой и промыть крылья носа.
Хранить вещество следует в сухом прохладном месте, в плотно закрытой жесткой пластиковой или стеклянной упаковке, отдельно от лекарств, пищевых продуктов и кормов для животных, в недоступном для детей и животных месте.
Перед тем, как выбирать вещество для выращивания кристаллов или, если реактив у вас уже есть, начать выращивать из него кристаллы, рекомендую ознакомиться с таблицей растворимости. В ней я постарался собрать наиболее доступные вещества, из которых можно выращивать кристаллы дома и их растворимость на 100 гр воды при различной температуре.
Например: при 60 градусах в 100 гр воды растворяется 39,5 гр медного купороса, а при 25 градусах — 23,05 гр. Что это значит?
Для получения насыщенного раствора медного купороса при 60 o C вам потребовалось 39,5 гр вещества. При остывании до комнатной температуры, то есть примерно 25 o C, растворимость медного купороса составит около 23 гр, и около 16,5 (39,5-23) гр выпадут в осадок в виде мелких кристалликов или "прирастут" к вашей затравке.
Кроме того, эта таблица поможет вам определить, сколько раствора вы можете приготовить для выращивания кристаллов того или иного вещества.
| Растворимость вещества в гр на 100 гр воды при температуре | |||||||||
| 20-30 o C | 80-90 o C | 7,2 (20 o ) | 22,7 | 69 (50 o ) | 35,6 (20 o ) | 3,0 | 71,0 (80 o ) | 124 (25 o ) | 400 |
| 58,7 (37,8 o ) | 118 | 344 (50 o ) | 201,9 (20 o ) | 365,1 (80 o ) | 12,5 | 40 (50 o ) | |||
| 48 (50 o ) | 35,5 (20 o ) | 23,1 | 61,8 (60 o ) | 114 |
|||||
| 28,1 | 40,3 (40 o ) | 56,2 |
|||||||
| 36,80 (50 o ) |
В дальнейшем таблица будет дополняться и уточняться.
Если клеточка пропущена, значит точных значений растворимости найти не удалось.
Если значения растворимости отмечены вопросительным знаком, это значит, что данные нескольких источников разнятся. Они будут уточнены.
Таблица составлена по материалам Химической энциклопедии (жирным), Википедии (жирным курсивом).
Материал оказался полезен? Поделись с друзьями!
Есть вопросы или предложения? Комментарии открыты для вас!
J_G (Friday, 25 December 2015 21:11)
Советую растворимость медного купороса также добавить в таблицу,т.к. некоторые люди не читают что либо помимо таблицы,ибо ищут лишь точные цифры,без пояснений.
Борис (Saturday, 26 December 2015 01:26)
#1 J_G, но ведь медный купорос есть в таблице. Смотри Сульфат меди 5вод там ниже дописано, что это Медный купорос 🙂
Константин (Friday, 26 February 2016 23:07)
Доброго времени суток, Борис!
У Вас толковые статьи о кристаллах, спасибо Вам за это!
Мое единственное пожелание: поделитесь опытом, напишите статью о том, где можно купить вещества приведенные в таблице растворимости веществ. Я хоть к химии и близок, однако сам не знаю где достать многие вещества из таблицы помимо химических магазинов, которых в городе для частных лиц по сути нет =)
Спасибо!
Борис (Sunday, 28 February 2016 16:38)
#3 Константин, спасибо вам!
Всё пытаюсь написать статью о самых интересных и самых доступных веществах для выращивания кристаллов, но категорически не хватает времени. Надеюсь, что в ближайшее время смогу её добить.
Алексей Не Важно (Saturday, 23 April 2016 08:40)
Снова здравствуйте, Борис! Можете мне помочь: как пользоваться этой таблицей? Я ещё не слишком большой и не понимаю.
кристин (Tuesday, 13 September 2016 07:58)
Здравствуйте.
Скажите, пожалуйста, если к соли добавить марганцовки, это как-то повлияет на формирование строение кристалла?
Дмитрий (Thursday, 29 September 2016 19:26)
Подскажите ето не вредно делать в доме. Есть шанс что будут плохие последствия
Герман (Saturday, 21 April 2018 10:38)











